Перспективный способ восстановления деталей — гальванические покрытия. Благодаря простоте и доступности оборудования он может быть использован практически во всех звеньях ремонтной сети — от мастерских общего назначения до специализированных цехов ремонтных заводов. Однако следует отметить, что повышение эффективности гальванических процессов при восстановлении деталей, их широкое распространение возможно главным образом за счет механизации и автоматизации.
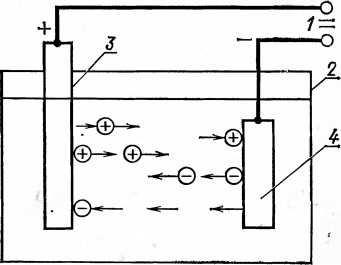
Рис. 18. Схема процесса электролитического
наращивания: 1 — источник тока;
2 — ванна; 3 — анод; 4 — катод.
Наибольшее распространение в ремонтном производстве получили такие гальванические процессы, как хромирование и железнение.
Наращивается металл на изношенные поверхности деталей электролитическим способом в результате электролиза. На рисунке 18 показана принципиальная схема процесса электролиза.
При прохождении электрического тока через электролит ионы электролита, отрицательно заряженные (анионы), движутся к аноду, положительно заряженные (катионы) — к катоду.
У кислот, оснований и солей положительно заряженными являются атомы водорода и металлов, отрицательно заряженными — кислотные остатки. Количество вещества, выделяющегося при электролизе на катоде, согласно законам Фарадея, определяют по формуле G—cItj где G — количество вещества, выделяющегося при электролизе, г; с — электрохимический эквивалент, г/А-ч; / — сила тока, A; t — время электролиза, ч.
Однако, кроме металла, на катоде выделяется водород и протекают другие процессы, на которые затрачивается определенная часть электроэнергии. В связи с этим в действительности металла будет осаждаться меньше, чем подсчитано по вышеприведенной формуле. Выход металла по току, в свою очередь, равен т=—100, тг где т — вес металла, фактически осажденного на детали, г; т — расчетный вес металла, который должен быть получен за время электролиза, г.
Среднее значение толщины слоя электролитического осадка при заданных плотности тока и продолжительности электролиза определяется по формуле, где б — толщина электролитического осадка, мм; Dk — плотность тока, А/дм2; t — продолжительность электролиза, ч; у — плотность осаждаемого металла* г/см3; с — электрохимический эквивалент, г/А-ч.
При осаждении металла силу тока относят к поверхности деталей, подлежащих покрытию, и пользуются понятием «плотность тока». По этой же формуле определяется время электролиза при заданной толщине покрытия.
 Сельхозтехника
Сельхозтехника